8月,浙江理工大学生命科学与医药学院付彩云教授课题组在国际经典肿瘤学期刊Cancer Letters发表了题为“Synergistic targeting of FASN and HMGCS1 by cerulenin enhances tumor cell ferroptosis sensitivity through rewiring lipid metabolism and blocking GPX4 biosynthesis”的研究论文,该研究通过高通量筛选技术筛选鉴定了一种新型铁死亡增敏剂Cerulenin,并揭示Cerulenin可通过双靶点FASN/HMGCS1发挥促铁死亡功能。该研究不仅揭示了一种全新的铁死亡代谢调控机制,更重要的是为解决肿瘤铁死亡抵抗问题提供了“一石二鸟”的创新性治疗策略,为发展下一代精准抗癌疗法奠定了坚实的理论基础。

铁死亡是由铁离子依赖的脂质过氧化物积累所导致的一种新型细胞死亡方式,其在形态学、遗传学和生物化学上均不同于其他已知的细胞死亡方式。目前,尽管对其生理功能的理解尚不全面,但大量证据表明,铁死亡与多种疾病的发病机制密切相关,包括缺血性器官损伤和神经退行性疾病。尤为引人注目的是,研究发现铁死亡在肿瘤治疗中也扮演着关键角色。这一重要发现使其成为治疗肿瘤的一个极具前景的新兴治疗靶点,为未来药物研发开辟了新的方向。但肿瘤细胞常通过代谢重编程获得对铁死亡的抵抗性,而限制铁死亡在肿瘤治疗中的广泛应用。
该研究通过高通量筛选发现Cerulenin可显著增强肿瘤细胞对铁死亡诱导剂(如erastin)的敏感性。研究发现其作用机制在于双靶点抑制:一方面抑制脂肪酸合成限速酶FASN,而间接抑制CPT1的酶活性,从而促使多不饱和脂肪酸(PUFA)积累,为脂质过氧化提供“底物”;另一方面抑制甲羟戊酸途径限速酶HMGCS1,而影响sec-tRNA成熟,进而阻碍GPX4的合成,削弱细胞防御能力。两者协同,彻底打破肿瘤细胞抵抗铁死亡的防御体系。TCGA数据分析显示,SLC7A11、FASN和HMGCS1在多种癌症中共同高表达且与患者不良预后相关。动物实验进一步证实,Cerulenin与erastin联用可显著抑制肿瘤生长。该研究为克服肿瘤细胞铁死亡抵抗,提供了强有力的双靶点治疗策略,具有重要的临床转化前景。
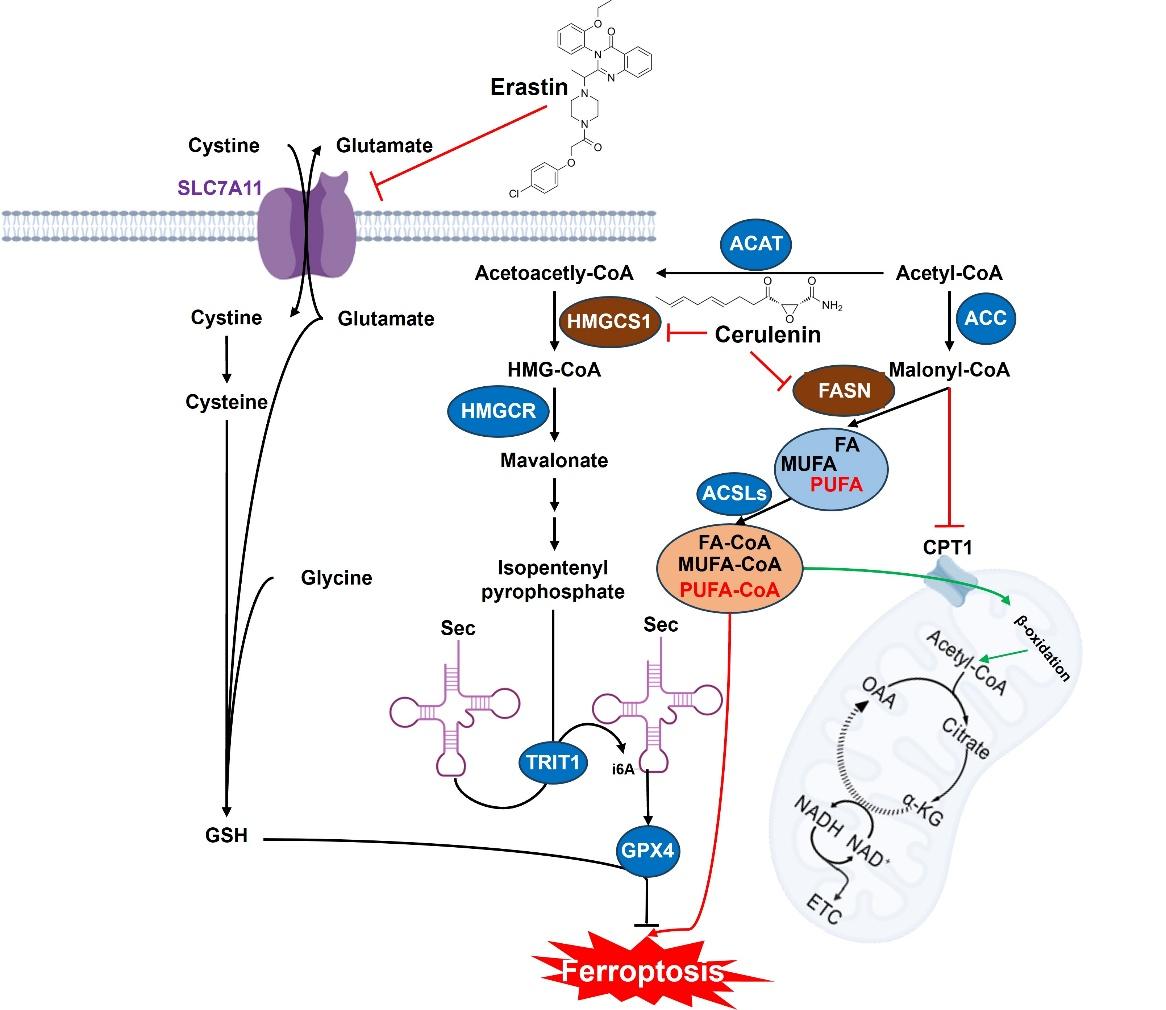
Cerulenin增强肿瘤细胞对铁死亡敏感性的调控示意
论文链接:https://doi.org/10.1016/j.canlet.2025.217992
作者简介:
付彩云,浙江理工大学生命科学与医药学院副院长,浙江理工大学多肽及蛋白药物研究所所长,教授,博士生导师,教育部“长江学者奖励计划”特聘教授,全国巾帼建功先进集体领衔人,青年多肽科学家奖获得者,重大疾病靶向治疗新技术和应用浙江省工程研究中心主任,中国科协十大代表,民进中央青工委委员。2008年博士毕业于兰州大学生命科学学院,师从王锐院士。
付彩云教授围绕肿瘤诊治新靶标发掘与新药物研发领域,以通讯作者或第一作者在Proc Natl Acad Sci USA(IF: 9.1),Adv Sci(IF: 14.1,3篇),J Am Chem Soc(IF: 15.6,2篇),Angew Chem Int Ed(IF: 16.9),Cancer Letters(IF:10.1),CoordinChem Rev(IF: 23.5,2篇),Adv Healthc Mater(IF: 9.6),Signal Transduct Target Ther(IF: 52.7,6篇),Mil Med Res(IF: 22.9)等杂志发表学术论文40余篇,4篇被遴选为封面论文,2篇入选ESI高被引论文和ESI热点论文。在肿瘤靶向治疗药物研发、肿瘤标志物鉴定领域以第一发明人授权国家发明专利10项(应用转化6项)。主持国自然(4项)和省自然重大项目在内的国家级和省部级项目13项。基于前期原创性发现,为实现研究成果的快速转化,已开展一项多中心随机对照前瞻性II期临床研究。
夏超义,浙江理工大学生命科学与医药学院师资博士后。研究方向聚焦于“细胞代谢参与调节细胞铁死亡过程”的研究,致力于探究氨基酸代谢和小分子化合物对铁死亡的促进或抑制作用。以及运用多组学技术手段寻找新的可调控细胞死亡方式。研究成果以第一作者在国际高水平期刊Nature Communications, Redox Biology和Cancer Letters上发表,以合作者身份在The EMBO Journal、PNAS和elife发表多篇文章。主持浙江省青年基金一项,中国博士后特别资助一项。